大年初七,开工大吉!
新的一年有天昊的陪伴,
祝愿大家科研工作能如虎添翼、虎虎生威!
今天给大家介绍一篇2022年1月刚刚发表在《Microbiome》上的文章,该研究利用微生物宏基因组 + RNA-seq + 代谢组学联合分析的方法,揭示了1型糖尿病患者饮食与微生物群及免疫调节之间的联系。本文研究思路简洁流畅,实验设计及方法高效且有代表性,是一篇值得参考的多组学研究范文。下面研究者就简单 看一下这篇文章。

英文题目:Metabolite-based dietary supplementation in human type 1 diabetes is associated with microbiota and immune modulation
中文题目:1型糖尿病患者基于代谢物的饮食补充与微生物群和免疫调节相关
背景:肠道微生物群产生的短链脂肪酸(SCFAs)具有有益的抗炎和肠道稳态作用,可预防小鼠1型糖尿病(T1D)。SCFAs的减少预示着有益菌的损失,通常与包括T1D和二型糖尿病(T2D)在内的自身慢性免疫性和炎性疾病有关。在这里,研究者讨论了基于代谢物的膳食补充剂是否对T1D患者产生影响。研究者进行了一项单臂试验,用乙酸盐和丁酸盐(HAMSAB)修饰的高直链玉米抗性淀粉来评估安全性,同时监测肠道微生物群的变化,以调整免疫系统状态。结果:长期患有T1D的成年人服用HAMSAB补充剂6周,随访12周。粪便和血浆中SCFA乙酸盐、丙酸盐和丁酸盐浓度的增加与肠道微生物群的组成和功能的改变一致。虽然血糖控制和胰岛素需求没有变化,但SCFA浓度最高的受试者血糖控制最好。长双歧杆菌、青春双歧杆菌和维生素B7的产生与较低的HbA1c和基础胰岛素需求相关。干预后,循环B细胞和T细胞形成了更具调节性的表型。结论:补充HAMSAB 6周后,肠道微生物群组成、功能和免疫状况的变化与粪便和血浆中SCFAs的增加有关。这些效应的持久性表明,靶向膳食SCFAs可能是改变免疫特征、促进免疫耐受和改善T1D治疗血糖控制的机制。
短链脂肪酸是肠道微生物群产生的代谢产物,对人类健康和疾病有很大影响。SCFAs主要由不可消化的膳食碳水化合物发酵产生,主要是乙酸盐、丙酸盐和丁酸盐,具有抗炎作用,对维持肠道稳态至关重要,并在宿主能量代谢中发挥作用。针对微生物群的饮食干预,有助解决潜在的功能性生物失调(即SCFAs缺乏和微生物群功能改变),在人类预防或治疗T1D方面可能具有巨大的潜力 。
临床研究已经开始显示通过使用益生元、益生菌和粪便移植作为治疗炎症疾病的替代方法来调节微生物群组成的潜力。基于SCFA的补充剂是一种2型抗性淀粉,由高直链淀粉(70%)玉米淀粉(HAMS)组成,该淀粉通过结合乙酸盐和丁酸盐(HAMSAB)进行了改性。它能抵抗上胃肠道的消化,在结肠中产生非常高的SCFAs,是评估SCFAs对肠道生物学影响的有力工具。HAMSAB饮食防止了T细胞对β细胞的破坏,并在90%的NOD小鼠中防止了T1D。本研究首次报道了对T1D患者的介入研究,以确定通过肠道微生物群输送膳食乙酸盐和丁酸盐对免疫系统的影响。
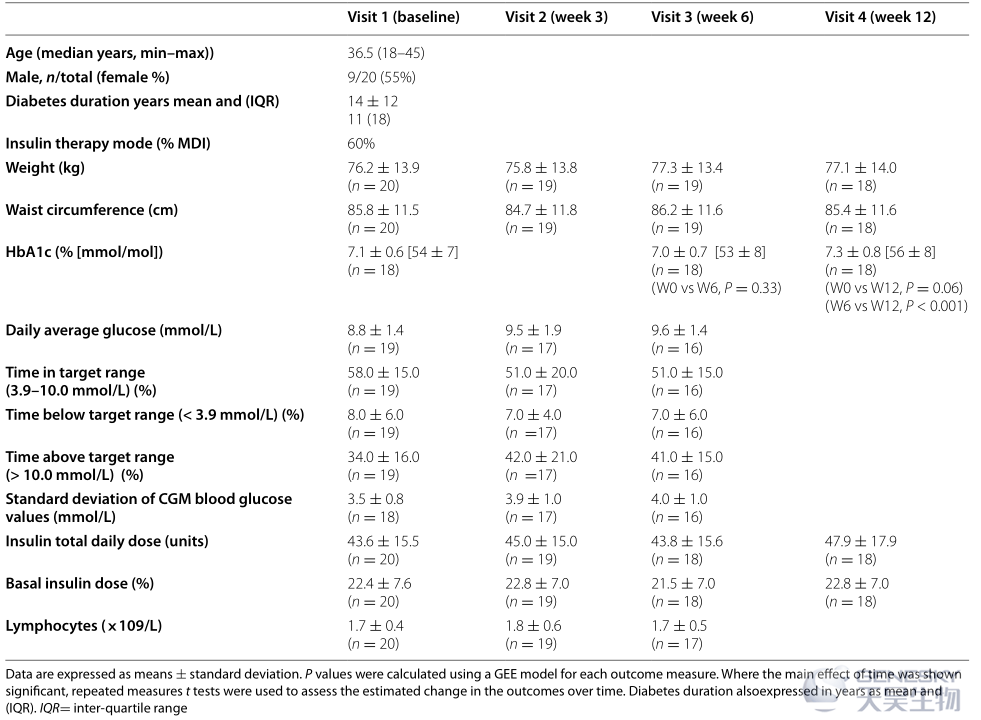
该试验是HAMSAB补充剂的单臂试验,作为日常饮食的一部分,每天给药两次,持续6周,并在T1D成人中随访12周。纳入标准包括18至45岁的男性和女性。受试者参加了4次随访(W0、W3、W6和W12)(图1)。为了提高耐受性,受试者HAMSAB补充剂从每天10 g开始,每48小时增加10 g剂量,直到达到每天40 g。从W0、W3和W6的受试者收集的血液和尿液样本进行了血清尿素、肌酐、电解质、肝功能测试、碳酸氢盐、甘油三酯和尿白蛋白分析。
SCFA分析是在基线W3、W6和W12(分别为n = 20、19、19和18)采集血浆样本,在基线W6和W12(分别为n = 20、19和18)采集粪便样本,并储存在–80℃直至处理。利用靶向代谢组学直接测定血浆(200 ml)和粪便样品中的SCFA含量。
宏基因组测序是在基线、W6和W12(分别为n = 20、19和18)收集受试者的粪便样本,使用NovaSeq平台(Illumina)进行宏基因组测序及标准化数据分析。
RNA-seq转录组分析是对来自受试者的全血样本,在基线和W6(分别为20和19)直接收集到含有RNA稳定剂的Paxgene试管中,然后在–80℃下储存。按照标准流程抽提RNA后,对来自W0和W6的样品进行转录组测序分析,以进行配对分析。
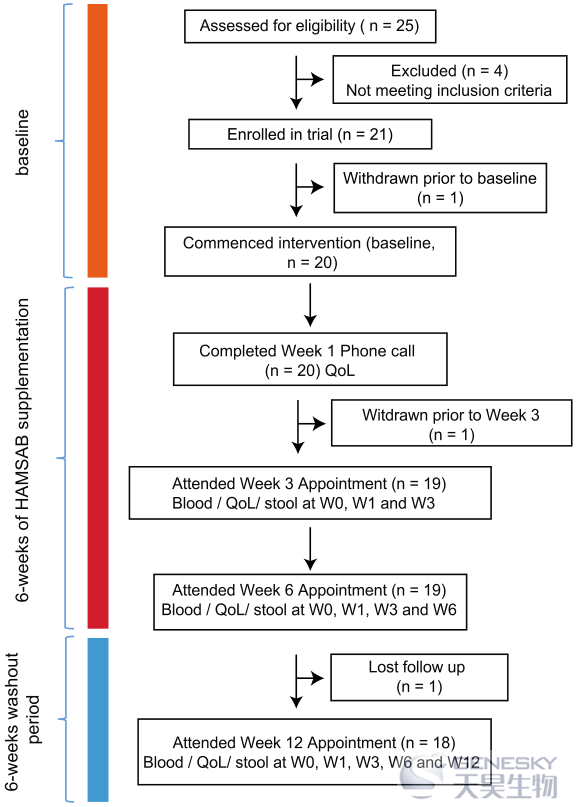
图1、T1D患者的实验研究设计示意图

在粪便中,大多数(77.7%)受试者的乙酸盐和丙酸盐浓度增加了> 2倍,61%的受试者在W6时丁酸盐浓度增加了> 2倍(图2A)。经过6周的清除期后,超过50%的受试者粪便中的短链脂肪酸浓度继续比基线高2倍以上。在血浆中,补充HAMSAB周后,醋酸盐浓度开始显著升高,在W6达到最大峰值(58%的受试者血浆醋酸盐浓度增加了2倍,图2B)。在W6时,血浆中丙酸盐和丁酸盐含量增加,但程度较轻,但也很显著。在W12,在6周洗脱期结束时,8/19受试者继续维持血浆中乙酸盐的浓度升高,但丙酸盐或丁酸盐的浓度不升高。因此,在补充HAMSAB后,大肠和循环中的SCFA利用率增加。
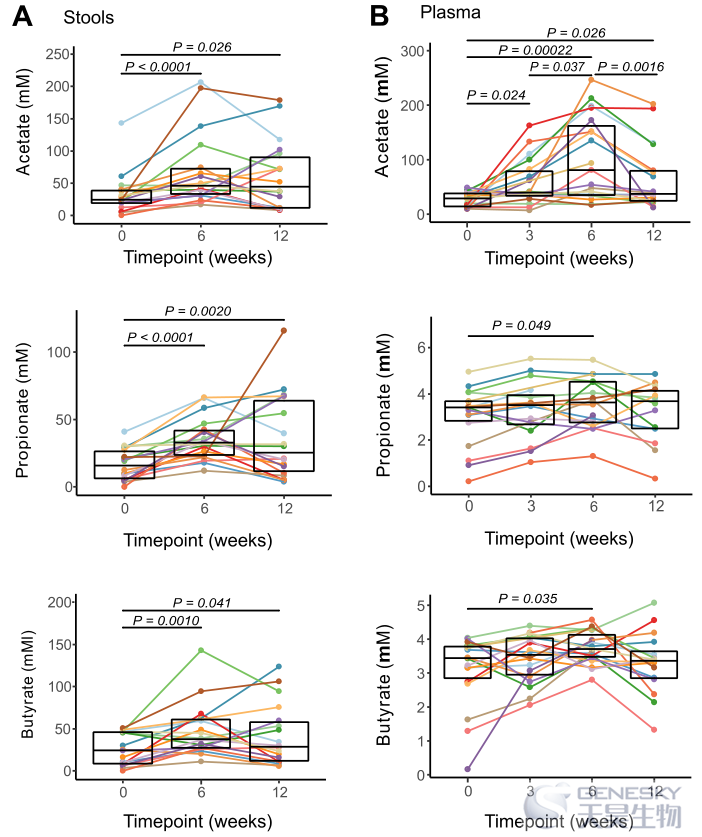
图2、补充HAMSAB后粪便和血浆中短链脂肪酸(SCFAs)浓度增加。该图显示了粪便(A)和血浆(B)中的乙酸盐、丙酸盐和丁酸盐的浓度变化结果。
粪便微生物组的高深度宏基因组测序发现,W6处微生物组的分类组成(次要结果)与基线和W12不同,基线和W12的组成更相似(图3)。这些数据显示了HAMSAB饮食后对肠道微生物群组成和功能产生了实质性的变化。
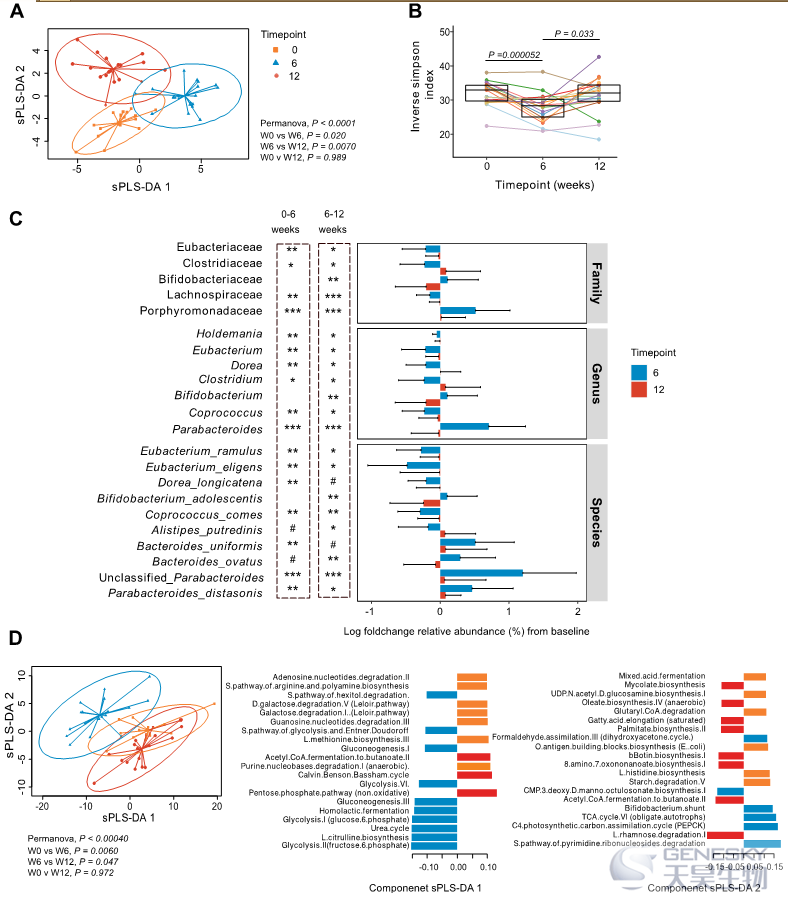
图3、补充HAMSAB后,肠道微生物群的组成和功能发生变化。
补充HAMSAB后,活化状态较低的循环边缘区B细胞增多, T细胞内免疫调节变化增加,循环促炎标记物减少,氧化磷酸化增加。这些数据再次表明,补充HAMSAB与免疫调节表型的免疫谱变化有关。
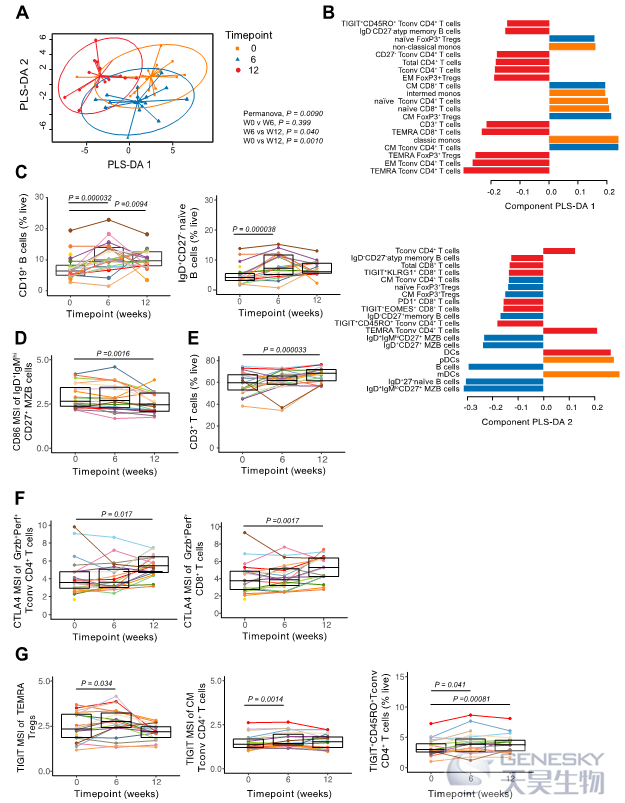
图4、补充HAMSAB伴随着W6和W12随访时期的免疫系统调节结果。
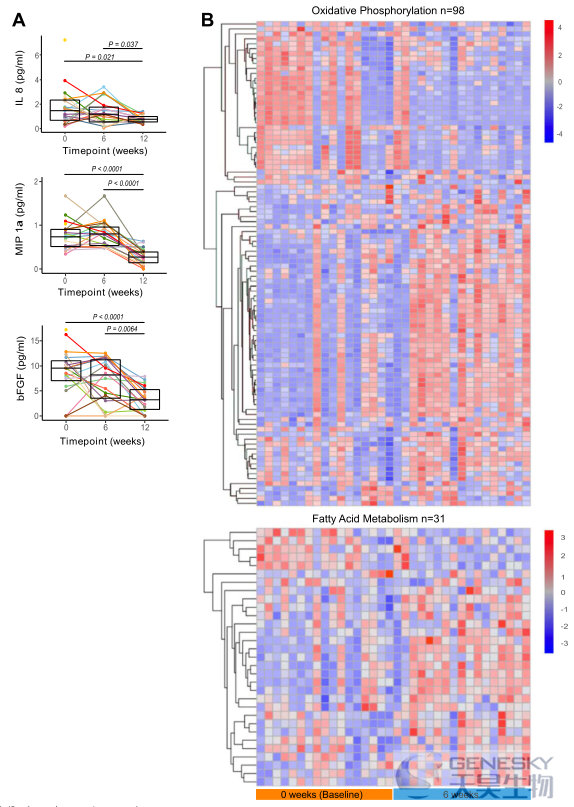
图5、补充HAMSAB后,受试者循环促炎介质在W12时期降低。
接下来,研究者探讨了SCFAs、临床参数以及宏基因组和免疫表型数据之间的关系。在W6,血浆丁酸盐与HbA1c、低于范围的时间和基础胰岛素剂量呈负相关(图6)。这些发现表明,肠道微生物群较高水平的双歧杆菌分类群和生物素生物合成,以及较高的局部乙酸盐和丁酸盐利用率,与T1D成年患者较好的血糖控制相关。
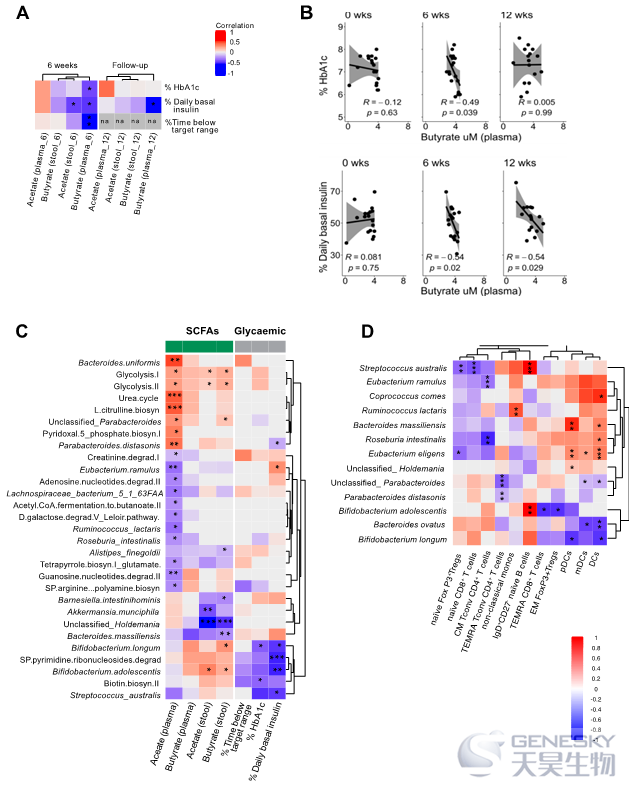
图6、短链脂肪酸(SCFAs)的增加与血糖控制、共生微生物群和免疫细胞的变化相关。

该研究旨在确定T1D背景下补充剂的安全性,并且不包括安慰剂对照组。尽管探索性的结果为补充HAMSAB对微生物群组成和免疫状态的影响提供了重要的见解。研究表明,补充HAMSAB会重塑肠道微生物群,并显著影响免疫系统。此外,研究者的研究验证了研究者在NOD小鼠中的临床前结果,表明HAMSAB补充剂是调节T1D中微生物群-宿主相互作用的生理和有效方法。该试验为在T1D进行适当功率的双盲安慰剂对照随机对照试验提供了必要的数据。抗炎饮食HAMSAB干预可能将成为一种广泛接受的、非侵入性的和高度可获得的手段,以保护新诊断的T1D患者或高风险患者的β细胞功能。
咨询沟通请联系
18964693703(微信同号)

创新基因科技,成就科学梦想

 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886















