巨噬细胞是乳腺肿瘤微环境的主要细胞组成部分。肿瘤中巨噬细胞浸润的程度与不良的临床结局相关。事实上,肿瘤相关巨噬细胞(TAMs)通过促进血管生成、提供肿瘤生长因子和增强肿瘤细胞侵袭转移来发挥致癌的作用。TAMs还发挥免疫抑制功能,从而防止NK和T淋巴细胞破坏肿瘤细胞。因此,靶向TAM的招募、生存和功能已成为主要的治疗目标。
尽管目前的典范认为TAMs具有促癌功能,但一些研究也强调了TAMs在特定疾病阶段或器官中的保护作用。具有相反的促肿瘤和抗肿瘤功能的不同巨噬细胞群可能在同一肿瘤中共存。因此,确定巨噬细胞的异质性程度是合理设计巨噬细胞靶向治疗的前提。
在人类乳腺癌(BC)中,巨噬细胞浸润已经用CD14、CSF1R或CD68等标记物进行了评估。然而,CD14和CSF1R也标记了未分化的单核细胞,而CD68在吞噬细胞中的表达尚未被完全表征。其他标记物如CD163、TIE2、MRC1/CD206或MARCO已被用于评估TAM表型异质性。单细胞RNA测序(scRNA-seq)研究已经证明替代激活是解释TAM异质性的主要机制。总之,TAM浸润人类BC的表型和功能多样性仍有待阐明。
2022年3月23日,法国巴黎文理研究大学科研团队在Cell杂志在线发表了最新研究成果“Tissue-resident FOLR2+ macrophages associate with CD8+ T cell infiltration in human breast cancer”,利用单细胞RNA测序在健康的乳腺和乳腺癌原发肿瘤中发现组织驻留的FOLR2+巨噬细胞,FOLR2+巨噬细胞定位于肿瘤基质的血管周围区域,并且与CD8+ T细胞相互作用。

研究首先发现CD14+细胞浸润与淋巴结(LNs)肿瘤侵袭程度相关。为了描述整个肿瘤浸润性CD14+细胞的异质性,作者通过流式细胞术对CD11c+HLA-DR+细胞进行分选,从未经治疗的6例luminal乳腺癌患者转移性LNs、原发肿瘤和的血液中分离了单核吞噬细胞,并进行scRNA-seq(如下图C)。共富集了约18000个髓细胞,主要包括4群单核吞噬细胞(如下图D-E)。其中cluster 2(c2)选择性高表达TAM特征,而APOE的表达能够区分TAM和CD14+单核细胞及CD1c+树突细胞(如下图F)。进一步流式分析显示APOE和CCR2表达能够区分TAM和单核细胞,APOE+巨噬细胞频率随肿瘤负荷增加,而CCR2+单核细胞降低。这一数据表明APOE能够作为特异性marker识别luminal乳腺癌原发灶和LNs转移灶中的巨噬细胞。
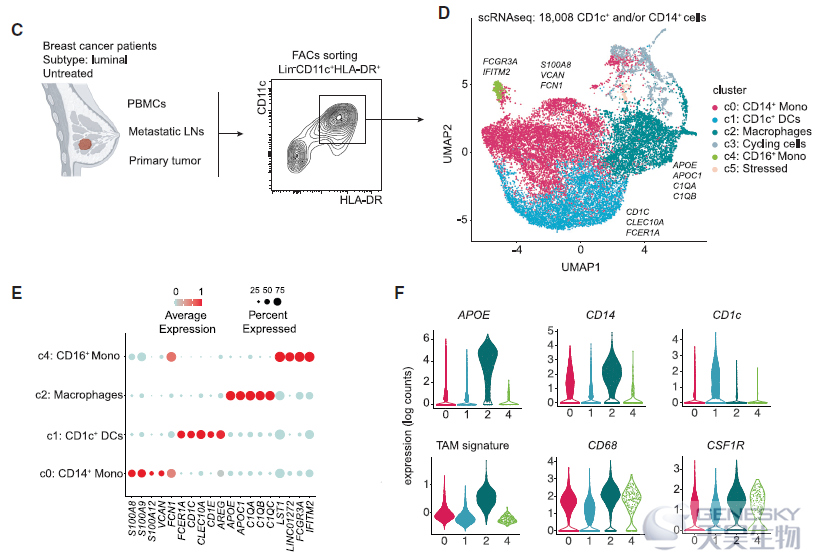
进一步研究APOE+ TAMs的异质性,识别出3个TAMs亚群。层次聚类表明,与c2相比, c0和c1在转录上彼此更接近。通过单细胞调控网络推断和聚类(SCENIC)分析及差异表达分析能够总结出APOE+ TAMs包括两个不同的亚群:TREM2+巨噬细胞和FOLR2+巨噬细胞(如下图)。为了验证这一发现,作者利用流式细胞术分析亚群的细胞表面蛋白表达,FOLR2和CADM1(TREM2无法作为细胞表面蛋白进行检测)的表达能够区分FOLR2+和TREM2+巨噬细胞。而且利用bulk RNA-seq和CyTOF分析证实了不同亚群间转录和蛋白表达差异。这些结果表明,乳腺TAMs由两个亚群组成,可通过它们相互排斥的表达TREM2/CADM1和FOLR2来分离。
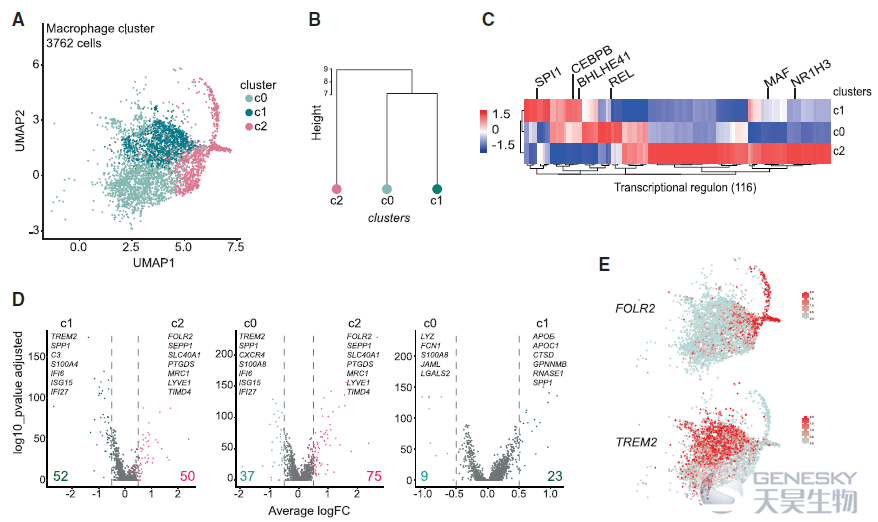
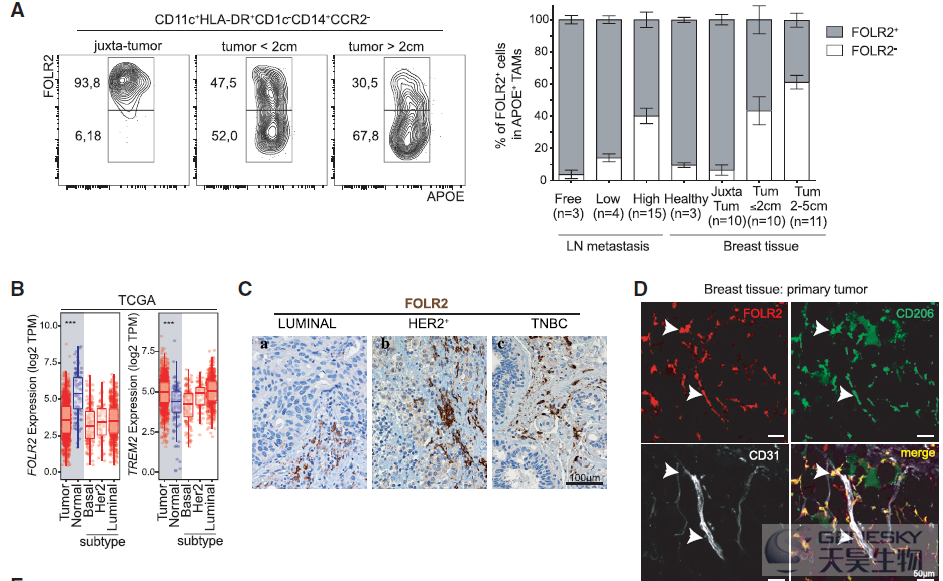
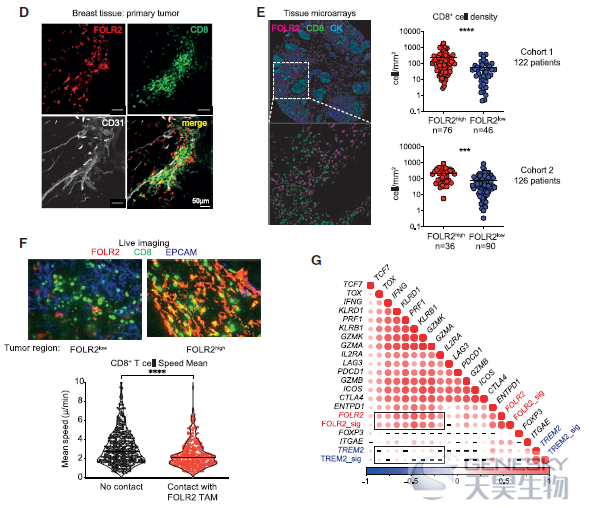
TREM2+巨噬细胞被报道与肿瘤进展相关,但是FOLR2+巨噬细胞的来源并不清楚。因此,想知道它们是否与乳腺组织驻留的巨噬细胞 (TRMs,即存在于健康乳房中)或肿瘤招募单核细胞来源的巨噬细胞(如TREM2+巨噬细胞)相对应。为了解决这个问题,作者利用流式细胞术发现FOLR2+巨噬细胞在健康和肿瘤旁的组织中富集。肿瘤进展时,FOLR2+巨噬细胞的频率相对被FOLR2-巨噬细胞稀释(如下图A)。TCGA数据也证实FOLR2在正常组织中高表达(如下图B),免疫组化显示FOLR2+巨噬细胞存在于乳腺癌所有亚型中(如下图C)。肿瘤切除标本的共聚焦成像显示,FOLR2+CD206+巨噬细胞确实位于肿瘤和邻近组织的CD31+血管附近(如下图D)。这些结果表明,FOLR2+巨噬细胞是与健康乳腺相关的血管周围的TRMs。另外,对小鼠模型的scRNA-seq发现FOLR2+巨噬细胞在鼠和人的luminal乳腺肿瘤中进化保守,作为TRM亚群持续存在于晚期癌症中。
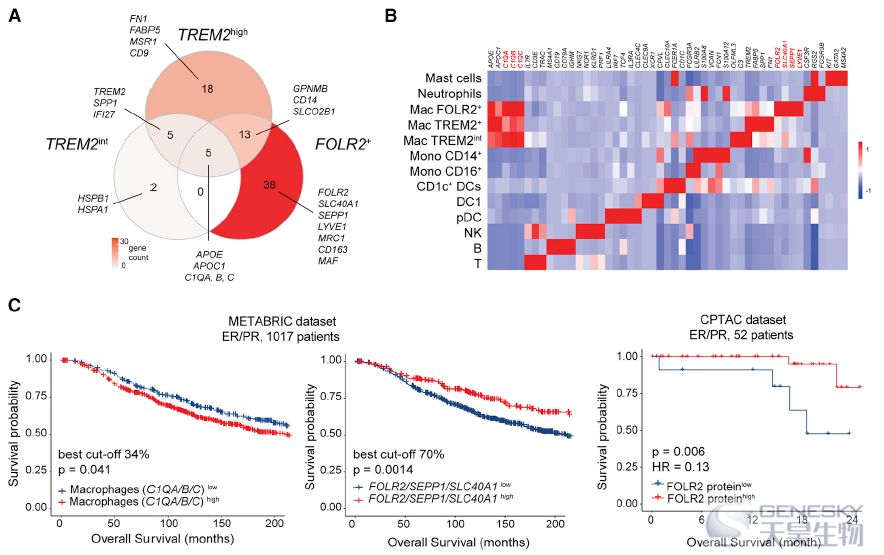
为了确定FOLR2+巨噬细胞是否与BC患者较差的生存率有关联。利用C1QA, C1QB和C1QC这3个基因定义了本研究中巨噬细胞群共享的核心巨噬细胞特征,利用FOLR2, SEPP1和SLC40A1将FOLR2+巨噬细胞与其它细胞区分开来(如下图A-B)。结果发现巨噬细胞浸润水平最高与较差的总生存相关。与之形成鲜明对比的是,高FOLR2基因特征与增加的总生存率相关。利用CPTAC数据集也发现FOLR2蛋白的丰度与更好的存活率呈正相关(如下图C)。进一步评价FOLR2+巨噬细胞的细胞密度是否与良好的临床结果相关,利用多重免疫荧光证实了FOLR2+巨噬细胞密度与患者生存期呈正相关。这些结果表明,FOLR2基因特征和FOLR2+巨噬细胞丰度与BC患者更好的预后相关。
表达FOLR2的巨噬细胞在健康的人体组织中已有发现,因此,作者想确定不同的癌种中是否存在FOLR2+巨噬细胞。结果发现多种癌症中存在FOLR2+巨噬细胞(如下图A),空间分布定量显示FOLR2+细胞在肿瘤基质中一致存在,而很少浸润肿瘤巢(如下图B)。而且,FOLR2+和TREM2+巨噬细胞在空间上是分开的,它们在基质中的丰度与BC患者不同的临床结局相关。

为了进一步了解其功能,作者使用FOLR2基因特征或单独的FOLR2表达,将FOLR2+巨噬细胞的丰度与肿瘤微环境中的其他免疫细胞和基质细胞类型关联起来。结果发现FOLR2基因特征(或FOLR2基因)与CD8+ T细胞、树突细胞、B细胞和三级淋巴结构(TLSs)等已知的抗肿瘤免疫参与者呈现正相关。相反,TREM2+巨噬细胞基因特征或TREM2单独表达与T细胞、CD8+ T细胞、NK细胞或B细胞无关。对bulk RNA-seq数据分析发现趋化性和免疫应答调节功能模块是富集在FOLR2+巨噬细胞中的基因通路。这些结果表明,FOLR2+巨噬细胞是抗肿瘤免疫开始的免疫环境的一部分。
利用共聚焦显微镜作者发现FOLR2+巨噬细胞与CD8+ T细胞聚集密切相关(如下图D),而且FOLR2+巨噬细胞含量高的肿瘤中CD8+ T细胞密度明显高于FOLR2+巨噬细胞含量低的肿瘤(如下图E)。为了进一步研究FOLR2+巨噬细胞是否与CD8+ T细胞有效结合,对新鲜的人类BC病灶进行了共聚焦活体成像(如下图F),结果反复观察到CD8+ T细胞降低了它们的速度,并与FOLR2+巨噬细胞建立了长期的接触。与此相反,在FOLR2缺失的肿瘤区域,CD8+ T细胞的能动性更高。因此,作者得出结论:CD8+ T细胞与FOLR2+巨噬细胞建立了长期的相互作用,这一行为可能会促进T细胞的激活。
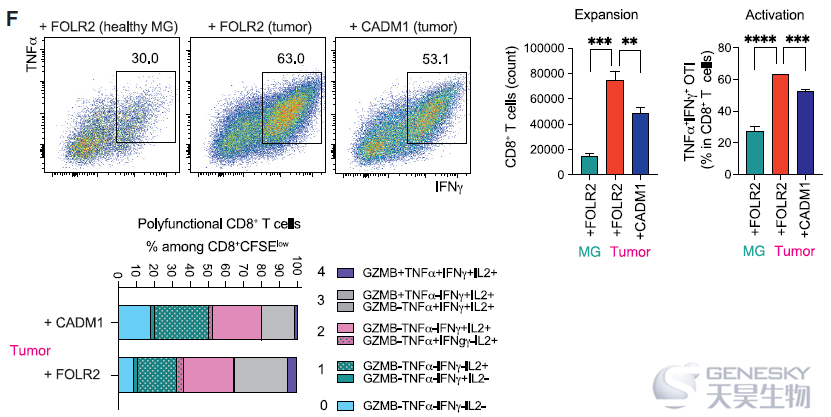
新生肿瘤已被证明与TRMs进行细胞交流,从而促进肿瘤生长、运动和侵袭性。为了探索FOLR2+巨噬细胞的功能特征,作者将研究转向PyMT BC小鼠模型。对从健康小鼠及不同大小肿瘤小鼠的乳腺中分离的FOLR2+巨噬细胞进行了bulk RNA-seq,发现FOLR2+巨噬细胞以肿瘤大小依赖的方式改变了它们的转录组,肿瘤和健康乳腺组织中FOLR2+巨噬细胞转录差异显著。进一步利用抗原特异性T细胞启动试验,将FOLR2+和CADM1+巨噬细胞与初始OTI CD8+ T细胞共培养,发现FOLR2+巨噬细胞表现出更强的诱导naive T细胞激活、扩张、多功能性和细胞毒性功能的能力)。此外,从健康乳腺中分离的FOLR2+巨噬细胞不能有效激活OTI CD8+ T细胞,而从乳腺肿瘤中分离的FOLR2+巨噬细胞可以诱导T细胞的扩张和分化(如下图)。这些结果证实了FOLR2+巨噬细胞在肿瘤发展过程中被激活,并获得启动CD8+ T细胞的能力。总之,这些结果提供了FOLR2+巨噬细胞不像免疫抑制细胞的证据。相反,肿瘤相关的FOLR2+巨噬细胞是强有力的抗原呈递细胞,显示出触发CD8+ T细胞激活的功能。
这项研究在健康乳腺和乳腺癌原发肿瘤中发现了一群离散的FOLR2+组织常驻的巨噬细胞群。FOLR2+巨噬细胞定位于肿瘤基质的血管周围区域,在那里它们与CD8+ T细胞相互作用。FOLR2+巨噬细胞在体外有效地引导CD8+ T细胞。肿瘤中FOLR2+巨噬细胞的密度与患者的生存率呈正相关。这项研究强调了肿瘤相关的巨噬细胞亚群的特定作用,并在以巨噬细胞为基础的癌症治疗中为亚群靶向的治疗干预铺平了道路。
咨询沟通请联系
18964693703(微信同号)

创新基因科技,成就科学梦想

 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886









