
 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886

●单细胞多组学

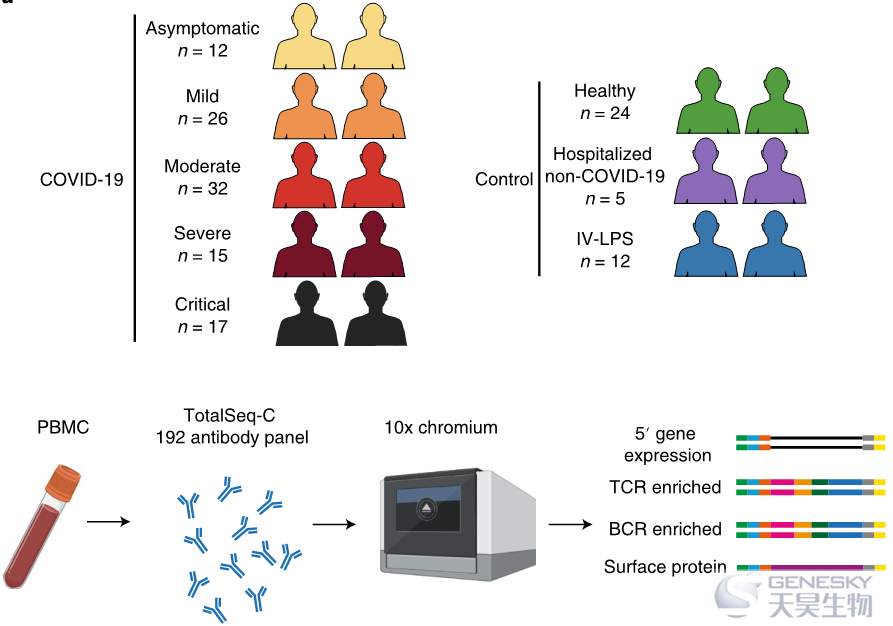


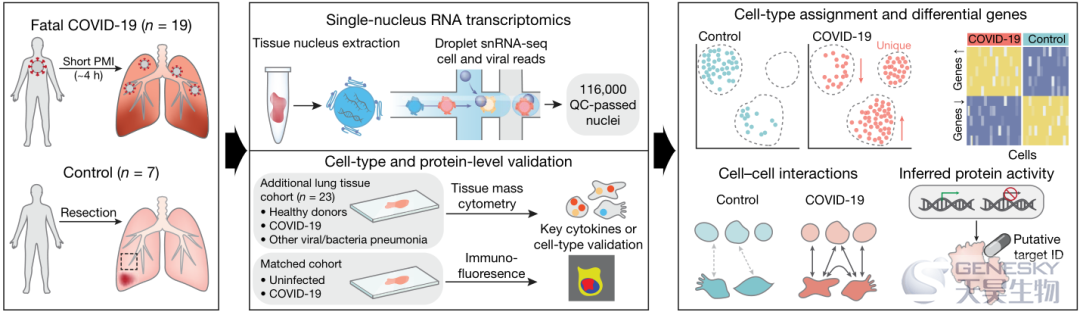

●抗原呈递细胞的单细胞图谱


●特异性B细胞单细胞图谱


●单细胞测序验证髓系受体表达


●胰岛单细胞测序



●多组学数据整合分析


●B细胞单细胞VDJ+RNA测序


●mRNA疫苗接种+单细胞验证

电话:18964693703(微信同号)

创新基因科技,成就科学梦想
微信扫一扫
关注该公众号