2019冠状病毒病(COVID-19),由严重急性呼吸综合征冠状病毒2(SARS-CoV-2)引起,据世界卫生组织统计,截至2021年8月30日,已造成2.16亿人感染,至少449万人死亡。单细胞RNA测序(scRNA-seq)在解析免疫反应方面有强大的能力,已被广泛应用于COVID-19的研究,现整理2021年以来部分重要研究中scRNA-seq相关内容供读者阅读参考:

▲scRNA-seq揭示调控机制:巨噬细胞和T细胞之间的反馈环路

感染SARS-CoV-2的一些患者发生严重肺炎和急性呼吸窘迫综合征(ARDS)。这些患者的独特的临床特征使人们猜测,SARS-CoV-2感染的肺泡中对病毒的免疫反应不同于其他类型的肺炎。这项研究收集了88例SARS-CoV-2致呼吸衰竭患者和211例已知或疑似其他病原体引起的肺炎患者的支气管肺泡灌洗液样本,并对其进行流式细胞术和bulk转录组分析。并对插管48小时内采集的10例重症COVID-19患者支气管肺泡灌洗液进行单细胞RNA测序。在大多数SARS-CoV-2感染患者中,肺泡腔持续富集T细胞和单核细胞。整体和单细胞转录组分析表明,SARS-CoV-2感染肺泡巨噬细胞,巨噬细胞反过来通过产生T细胞趋化因子做出反应。这些T细胞产生干扰素γ,诱导肺泡巨噬细胞释放炎症细胞因子,进一步促进T细胞活化。总的来说,这项研究结果表明,SARS-CoV-2导致缓慢展开的空间有限的肺泡炎,其中肺泡巨噬细胞窝藏SARS-CoV-2和T细胞形成一个正反馈环路,驱动持续的肺泡炎症。
▲大型单细胞免疫图谱:新冠肺炎单细胞研究中国联盟重大成果!

COVID-19患者的功能失调免疫反应是影响症状和死亡率的一个反复出现的主题,但对相关免疫细胞的详细了解尚不完整。我国十多个省市四十多家医院大学和研究机构在2020年5月自发组建了“新冠肺炎单细胞研究中国联盟(Single Cell Consortium for COVID-19 in China (SC4))”,旨在协同建立新冠肺炎单细胞转录组大队列大数据,为揭示新冠肺炎发病机制和免疫学特征发出中国的声音。这项研究对196名COVID-19患者和对照组的284个样本(包括痰液、肺泡灌洗液、胸水、外周血等)进行了单细胞RNA测序,并利用146万个细胞超过25T数据创建了一个全面的免疫图谱。庞大的数据集使我们能够确定不同的外周免疫亚型变化与不同的临床特征相关,包括年龄、性别、严重程度和COVID-19的疾病分期。SARS-CoV-2 RNA存在于多种上皮细胞和免疫细胞中,并在病毒阳性细胞中出现显著的转录组变化。S100A8/A9的系统性上调,主要是外周血巨核细胞和单核细胞中,可能是重症患者中常见的细胞因子风暴的原因。这些数据为理解COVID-19的发病机制和制定有效的治疗策略提供了丰富的资源。


▲疫苗研发与scRNA-seq:揭示疫苗保护下的细胞特征

为了完全控制SARS-CoV-2大流行,可能需要采取多种疫苗接种方法。这项研究证明了改良的安卡拉痘苗载体(MVA)表达膜锚定融合前稳定刺突(MVA/S),但不分泌S1在小鼠中诱导了对SARS-CoV-2的强烈中和抗体应答。在猕猴中,MVA/S疫苗诱导了强大的中和抗体和CD8+ T细胞应答,并在鼻内和气管内挑战后的第2天就对SARS-CoV-2感染和病毒在肺部复制提供了保护。感染后第4天肺细胞的单细胞RNA测序分析显示,MVA/S疫苗也可以保护猕猴免受感染诱导的炎症和B细胞异常,并降低干扰素刺激基因的诱导。这些结果表明,MVA/S疫苗在血液和肺中诱导中和抗体和CD8+ T细胞,是一种潜在的SARS-CoV-2疫苗候选。
▲单细胞测序meta分析:不同组织样本中病毒进入基因

血管紧张素转换酶2(ACE2)和辅助蛋白酶(TMPRSS2和CTSL)是SARS-CoV-2细胞进入所必需的,它们的表达可能揭示病毒的嗜性和对全身的影响。通过107个来自不同组织的单细胞RNA测序研究,研究人员评估了ACE2、TMPRSS2和CTSL的细胞类型特异性表达。ACE2、TMPRSS2和CTSL在鼻腔、气道和肺泡的呼吸道上皮细胞的特定亚群中以及与COVID-19传播或病理相关的其他器官细胞中共同表达。另外对31项肺单细胞RNA测序研究进行了meta分析,包括来自228个个体的377例鼻腔、气道和肺实质样本中的1,320,896个细胞。这揭示了年龄、性别和吸烟与ACE2、TMPRSS2和CTSL表达水平的细胞类型特异性关联。进入因子的表达随着年龄的增长及在男性中增加,包括在气道分泌细胞和肺泡2型细胞中增加。ACE2+TMPRSS2+细胞在鼻、肺和肠道组织中共享的表达程序包括可能介导病毒进入、关键免疫功能和上皮巨噬细胞交互的基因,如参与白介素-6、白介素-1、肿瘤坏死因子和补体通路的基因。细胞类型特异性表达模式可能有助于COVID-19的发病机制,这项工作强调了治疗干预的推断分子通路。
▲基因组筛选+单细胞验证:发现关键宿主因子TMEM41B

COVID-19大流行造成了全球经济和健康危机。为了确定冠状病毒感染的宿主因素,研究人员对SARS-CoV-2和人冠状病毒229E进行了全基因组功能遗传筛选。这些筛选发现了病毒特异性以及共享的宿主因子,包括TMEM41B和PI3K 3型。结果发现SARS-CoV-2需要溶酶体蛋白TMEM106B来感染人类细胞系和原代肺细胞。TMEM106B过表达增强了SARS-CoV-2感染和假病毒感染,提示其在病毒进入中起作用。此外,对COVID-19患者气道细胞的单细胞RNA测序显示TMEM106B表达与SARS-CoV-2感染相关。目前的研究发现了一组冠状病毒宿主因子,这些因子可能被用于开发对抗SARS-CoV-2感染或未来人畜共患病冠状病毒暴发的药物。

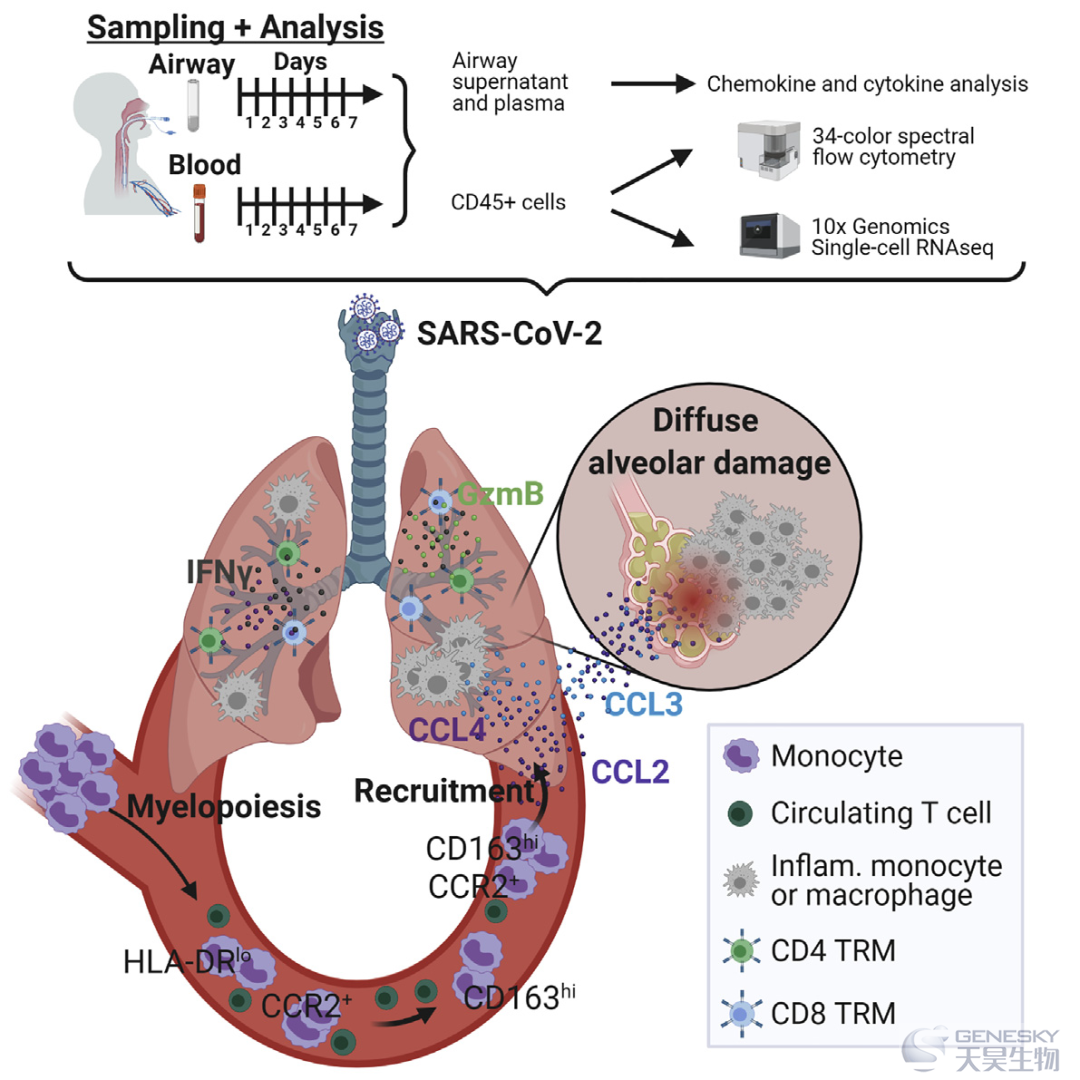
▲纵向样本单细胞转录组:髓细胞驱动肺炎症特征

COVID-19的免疫反应动力学及其严重临床表现已经在循环系统中进行了大量研究。这项研究通过对严重COVID-19患者配对气道和血液样本相对于健康对照组的纵向表型、转录组和细胞因子分析,研究了呼吸道免疫过程和循环之间的关系。在COVID-19呼吸道,T细胞表现出激活、组织驻留和保护特性;更高的T细胞频率与生存和年轻有关。COVID-19气道中的髓细胞具有高炎症特征,这些细胞的较高频率与死亡率和老年相关。在COVID-19血液中,异常CD163+单核细胞占比高于常规单核细胞,并在相应的气道样本和受损肺泡中被发现。气道中高水平的骨髓趋化因子表明这些细胞通过CCL2-CCR2趋化因子轴招募。这项发现为推动COVID-19肺病理的免疫过程提供了见解,并对靶向呼吸道炎症的治疗具有指导意义。

▲Bulk+单细胞转录组:发现了保守的保护性和有害基因模块

病毒感染引起与细菌感染不同的保守宿主反应。作者假设保守反应与疾病严重程度有关,并且在不同结局的患者之间存在差异。为了验证这一点,该研究整合了来自18个国家34个队列的4,780名0至90岁感染了16种病毒(包括SARS-CoV-2、埃博拉、基孔肯雅和流感)之一的患者的血液转录组谱,以及来自三个队列的289个样本的702,970个免疫细胞的单细胞RNA测序图谱。严重的病毒感染与造血、骨髓和骨髓源性抑制细胞的增加有关。研究确定了保护性和有害的基因模块,它们定义了与轻度和重度结果相关的不同轨迹。在预后严重的患者中,干扰素反应与保护性宿主反应脱钩。无论年龄和病毒如何,这些发现都是一致的,并为加速诊断和宿主导向疗法的开发提供了见解,以改进全球大流行的防范。



尽管出现了包括味觉丧失、口腔干燥和溃疡、脓疱和斑疹等粘膜病变在内的感染迹象,但人们对COVID-19涉及口腔的情况知之甚少。为了解决这个问题,研究人员生成并分析了人类小唾液腺和牙龈的两个单细胞RNA测序数据集(9个样本,13,824个细胞),识别出50个细胞簇。通过整合细胞归一化和注释,在腺体和牙龈之间划分了34个独特的细胞亚群。SARS-CoV-2病毒进入因子ACE2和TMPRSS成员广泛富集于腺体和口腔黏膜上皮细胞。通过正交RNA和蛋白表达评估,研究证实了SARS-CoV-2在腺体和粘膜感染。SARS-CoV-2感染个体的唾液含有表达ACE2和TMPRSS的上皮细胞,并持续感染SARS-CoV-2。无症状个体的非细胞和细胞唾液部分被发现在体外传播SARS-CoV-2。匹配的鼻咽部和唾液样本显示出独特的病毒脱落动力学,唾液病毒负荷与COVID-19症状相关,包括味觉丧失。在康复后,该无症状队列显示持续唾液抗SARS-CoV-2 IgG抗体。
▲单细胞+多组学:发现MIS-C免疫失调和自身反应与疾病程度相关

儿童多系统炎症综合征(MIS-C)是在轻微或无症状感染SARS-CoV-2数周后不可预测地发生的一种危及生命的感染后并发症。该研究使用单细胞RNA测序、流式细胞术、抗原受体库分析和无偏血清蛋白组学对MIS-C、成人COVID-19、健康儿童和成人进行了分析,这些分析共同确定了MIS-C患者与疾病严重程度相关的特征。尽管没有活动性感染的证据,但MIS-C患者S100A家族警报素升高,抗原呈现特征降低,指示髓系功能障碍。MIS-C患者NK和CD8+ T细胞细胞毒性基因表达升高,特异性表达IgG的浆母细胞扩增。临床重度MIS-C患者表现为偏移的记忆T细胞TCR库和以内皮反应性IgG为特征的自身免疫。研究定义的警报素、细胞毒性、TCR库和浆母细胞特征在临床上有应用的潜力,可以更好地诊断和预测MIS-C病程早期的疾病严重程度。

创新基因科技,成就科学梦想

 咨询热线:400-065-6886
咨询热线:400-065-6886

 咨询热线:400-065-6886
咨询热线:400-065-6886





















